新型生物活性玻璃和磷酸鈣材料研究進展(上)
信息來源: http://sharewhatyouteach.com 時間:2018-10-30 16:23:09
來源: 本文刊登于《中國醫療器械信息--醫療器械設計與制造》特刊2017年版 ,作者:杜昶 陳曉峰,單位:華南理工大學 (廣州 510641)
內容提要:生物活性玻璃和磷酸鈣生物陶瓷是重要的硬組織修復材料,含有與骨、牙齒組織相類似的成分。本文概述了生物活性玻璃和磷酸鈣材料在制備方法及性能研究方面的一些進展,探討了其在硬組織修復方面的應用前景。
關 鍵 詞:生物活性玻璃 磷酸鈣 仿生合成
生物活性玻璃和磷酸鈣生物陶瓷具有優異的生物活性和骨結合性,主要用于人工骨、人工關節、種植牙和齒科修復領域。生物活性玻璃是最初由佛羅里達大學的Hench 教授于19 世紀70 年代研制開發出來的具有特定組成且能滿足特定生物功能的硅酸鹽體系的特種玻璃材料,其在植入體內后能與骨組織緊密結合,并產生鍵合作用而不產生炎癥等不良的反應,具有良好的生物相容性和生物活性[36,37],因而引起了眾多研究學者的高度關注,并且隨著材料制備技術的發展,生物活性玻璃的制備工藝、化學組成、組織結構以及理化性能也在不斷改進,得到了不斷向前的發展,應用前景也越來越廣泛。磷酸鈣是磷酸鈣鹽的總稱,能細分為多種的磷酸鈣,不同的磷酸鈣具有不同的晶體結構,在磷酸鈣鹽中最具有代表性的是羥基磷灰石(HA)(Ca10(PO4)6(OH)2),是磷酸鈣的最穩定的狀態,同是也是骨骼和牙齒中含量最多的磷酸鈣鹽。
1.生物活性玻璃研究
1.1 生物活性玻璃的制備技術
1.1.1 熔融法生物玻璃
熔融法生物玻璃是第一代生物玻璃,也是臨床上應用廣泛的生物活性玻璃。熔融法生物玻璃的制備方法與普通玻璃的方法類似,首先將一定純度的粉體原料按照一定化學計量比均勻混合, 然后將混合原料在高溫條件下 (1300~1500?C)熔融,再將高溫熔體在水中淬冷,最后通過干燥、研磨和過篩得到生物活性玻璃粉體。其中臨床應用最廣泛、最具代表性的是45S5 生物玻璃,其化學組成(質量比)為24.5%Na2O-24.5%CaO-45%SiO2-6%P2O5 四元系統。研究發現,45S5 生物玻璃具有良好的生物相容性、高生物活性和優異的骨修復性能,其產品已在牙科和整形外科等臨床中得到很好的應用,如中耳骨修復、牙周缺損修復以及牙槽脊增高等,并取得良好的治療效果[31,38-41]。但是,熔融法自身卻存在一些不容忽視的缺點[42],比如高溫熔融工藝能耗較大,生物玻璃中的堿金屬成分在高溫下易腐蝕坩鍋造成成分污染,研磨過篩進一步導致有害雜質摻雜且導致顆粒形貌不規則、粒度不均勻,混料不均和分相現象導致成分不均勻,材料呈塊狀且致密無孔(如圖1),比表面積小,離子釋放和降解速度慢,不利于新生組織的的長入等。

1.1.2 溶膠- 凝膠生物活性玻璃
如上所述,熔融法能耗大、組分不可控、易引入雜質、結構致密、降解慢等缺陷,這些缺陷都可能限制生物活性玻璃的應用前景,因此,突破高溫熔融制備玻璃的限制,找到一種低能耗、反應溫和、組分可控、生物活性高、良好可降解性的合成工藝對生物活性玻璃的發展具有重要意義。
溶膠- 凝膠工藝是一種室溫條件下制備無機材料的常用工藝技術,同時此技術制備的粉體存在大量的微孔結構。為了改善熔融生物玻璃的一系列缺陷,研究者們開始嘗試利用溶膠- 凝膠工藝制備生物活性玻璃。
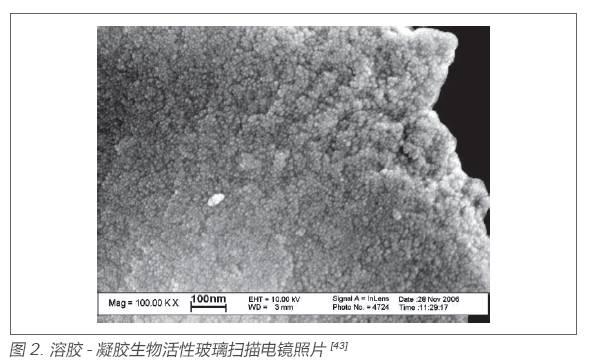
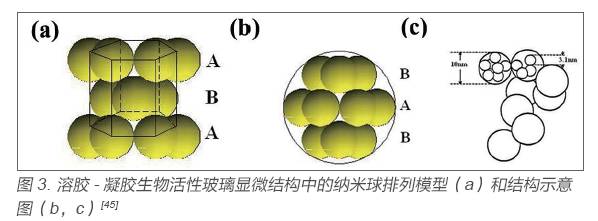
20 世紀90 年代,Hench 教授研究組通過溶膠- 凝膠工藝成功制備了生物活性玻璃。以正硅酸乙酯、磷酸三乙酯和硝酸鈣為原料作為Si、P 、Ca 的前軀體,在酸性催化劑的作用下,均勻水解形成生物玻璃溶膠,然后陳化得到生物玻璃凝膠,最后通過熱處理去除殘留有機物成功制備出CaOP2O5-SiO2 三元系統的生物活性玻璃[44]。溶膠- 凝膠生物活性玻璃相比于比熔融生物玻璃,結構更加疏松,本課題組李玉莉[43,45] 對其顯微結構表征發現,如圖2,溶膠- 凝膠生物活性玻璃是由大量納米級球形顆粒堆積而成,顆粒堆積形成大量的微納米孔,這種多孔的結構也賦予了其更大的比表面積,從而具有更快的HCA 形成速度,具有更高的生物活性。并對其微球堆積模型及孔隙結構進行分析,推測溶膠- 凝膠生物玻璃首先由3.1 nm 左右的一級球形納米粒子相互堆積而成了10 nm 左右的二級球形顆粒,再由這種二級球形顆粒堆積形成更大的三級球形顆粒,其中顆粒以ABABAB…的方式堆積排列,分析模型如圖3。
溶膠- 凝膠工藝的引入,使得生物活性玻璃在結構和性能上得到了極大的提升。相比于熔融生物玻璃,溶膠- 凝膠生物活性玻璃具有如下優點[46,47] :
(1)工藝簡單、制備條件更加溫和。制備過程基本上是在室溫下進行,后續的熱處理溫度也不超過800?C,遠低于熔融法所需溫度;
(2)化學成分的均勻性可達分子級別。反應溶液充分混合,使得溶液在約0.5 nm 的尺度內達到化學均勻,這同熔融法使用的微米級粉末原料的混合均勻度相比,提高104~105 倍;
(3)產品化學純度高。溶膠- 凝膠生物活性玻璃制備采用高純度的化學試劑為原料,保證了所得材料的純度,此外,還避免了高溫熔融時坩鍋對玻璃的高溫污染;
(4)材料的組成及分子結構可調。通過對材料的組成和分子結構進行調節設計從而賦予材料特定的理化和生物學特性,以滿足特定的組織修復需求;
(5)具有大量納米級微孔、比表面積較大,較高的化學活性和吸附特性,利于復合以及表面功能化或者活性分子的裝載,這些性質對于制備組織修復材料具有重要意義。
(6)易于制備超細粉體、薄膜、涂層、纖維等多種形式的生物活性玻璃材料,這是利用熔融法難以實現的。
基于上述優點,溶膠- 凝膠生物活性玻璃被生物材料領域譽為新一代的生物活性玻璃[3]。但是溶膠- 凝膠法也存在缺陷,雖然材料結構中存在大量納米級顆粒,但這些顆粒仍然處于粘結狀態,難以分散開的塊狀材料。通過研磨和篩分方法進行后期處理,得到的是形貌不規則且粒度不均勻的微米級顆粒。難以獲得形貌可控、顆粒尺寸均勻的微納米級生物活性玻璃[48,49]。
1.1.3 模板法溶膠- 凝膠生物活性玻璃
模板法生物活性玻璃是近年來興起的一類新型生物活性玻璃材料,是以有機化學、膠體化學為基礎,模板自組裝技術結合溶膠- 凝膠技術的基礎上發展起來的。為了解決傳統生物活性玻璃結構、形態不可控的問題,以表面活性劑為結構導向劑或者形態模板劑,它本身具有特定結構或形態,或者通過自組裝能形成特定形態結構,將其引入到反應體系中,而無機物前軀體聚合形成玻璃網絡結構,無機物前軀體和表面活性劑形成的膠束以均勻的形式在分子水平 上自組裝成具有特定結構形貌的有機無機復合聚集體,且隨著溶劑的不斷蒸發,從而使表面活性劑- 無機前軀體形成的自組裝聚集體的濃度越來越大,最后熱處理去掉模板從而得到具有特定結構或者特定形貌的生物活性玻璃材料[50-53]。
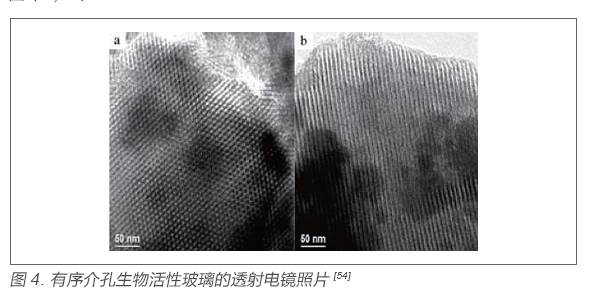
模板法制備生物活性玻璃在近十年間得到了迅速發展,早在2004 年復旦大學趙東元教授課題組[54] 利用溶膠- 凝膠工藝結合模板組裝技術,選用三嵌段共聚物P123 作為模板劑,首次制備了高度有序的介孔生物生物活性玻璃,相比于傳統的溶膠- 凝膠生物活性玻璃,前者具有更有序的介孔結構,更大的比表面積,也呈現出更快的磷灰石形成活性,圖4 為典型的有序介孔生物活性玻璃的透射電鏡照片。
本課題組郭常亮等[55] 采用表面活性劑吐溫-80 作為形態模板劑合成了生物活性玻璃納米簇(圖5)。生物活性玻璃納米簇的寬度約為50~120 nm,長度約為200~500 nm。從圖中可以觀察到納米線寬度約為10 nm,堆積形成納米簇,且堆積排列的納米線之間存在幾個納米的介孔孔隙。通過氮氣吸附- 脫附測試得出生物活性玻璃納米簇比表面積較高,達到205.3 m2/g。

本課題組雷波[56] 在溶膠- 凝膠制備過程中加入聚乙二醇(PEG)作為形態模板劑,通過PEG分子中的羥基和硅羥基的相互作用合成了具有球形形態的微米級生物活性玻璃(圖6),微球形貌和大小可以通過改變PEG 濃度來調節,且體外礦化表征和細胞學實驗顯示規則球形形貌的生物活性玻璃相比無規則的生物玻璃顆粒具有更好的磷灰石形成能力以及促細胞增殖與分化的能力。

1.1.4 微納米生物活性玻璃
人體天然的組織都具有獨特的微納米結構[57,58],如人體牙釉質是從納米到微米的七級分級微納米結構組織,骨組織由微納米的膠原纖維和羥基磷灰石組成,細胞外基質也具有典型的微納米結構,正因為如此特殊的結構, 天然組織具有傳統人工合成材料無法比擬的生物功能優勢。從仿生角度出發,這也為新型生物玻璃材料的設計提供了有益的參考。溶膠- 凝膠生物玻璃雖然具有比熔融法生物玻璃更高的比表面積和生物活性,但其內部顆粒仍處于粘結狀態,分散性差,需研磨、篩分制備粉體顆粒。所得粉體顆粒無規則、易團聚、比表面積較低、形貌尺寸不易控制,這些缺點影響了其活性離子的釋放,限制了其在組織缺損修復中的應用。如易團聚性導致制備性能穩定的微納米復合材料可能性降低,活性離子釋放量小;形貌不易控制影響材料活性離子溶出和對細胞介導作用;顆粒尺寸不可控,降低材料被組織和細胞吞噬效率,最終降低、基因的負載/ 轉染效率以及成骨介導活性。近年來國內外傾向于發展具有特定形貌、尺寸均勻、分散性好、結構可控的微納米生物活性玻璃材料(Micro/nano Bioactive Glass,MNBG),期望提高生物活性玻璃的組織缺損修復效率、基因和活性因子裝載效率和組織再生能力。顯然,采用模板自組裝技術與溶膠- 凝膠工藝相結合制備出具有規則形貌、特殊孔結構、特定性能的微納米生物玻璃是生物活性玻璃材料發展的一個重要方向。然而目前對MNBG 的研究主要還集中在制備、體外活性表征等方面[50,59-63],關于MNBG 的生物學性能的研究還鮮有報道, 而將MNBG 應用于牙髓組織損傷修復和再生的研究則少之又少。
1.2 生物活性玻璃的組成與結構
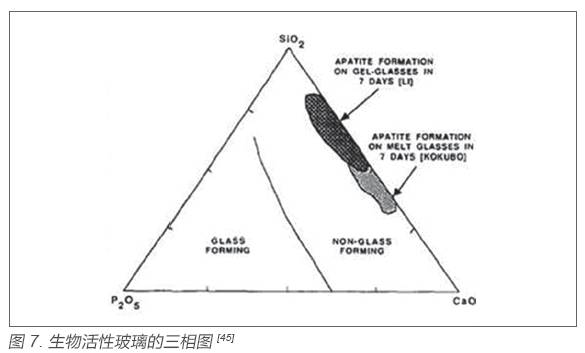
溶膠- 凝膠生物活性玻璃的化學組成不同于熔融法45S5 生物玻璃。相對于后者的Na2O-CaOSiO2-P2O5 四元系統而言,溶膠- 凝膠生物活性玻璃由于制備條件溫和,不需要為降低玻璃熔點而加入堿金屬元素鈉,因而組成中去掉了Na2O 組分,成為CaO-SiO2-P2O5 三元系統。而且溶膠-凝膠生物活性玻璃組成可調,SiO2 含量的上限比45S5 生物玻璃體系要高,圖7 為生物活性玻璃的三相圖,淺色陰影區域為熔融法生物玻璃,深色陰影區域為溶膠- 凝膠生物玻璃, 顯然后者的SiO2 含量顯著提高。熔融法生物玻璃中SiO2 含量一旦超過60 mol%,材料即喪失生物活性,因為隨著SiO2 含量增高,玻璃Si-O 網絡的連接程度越高,網絡結構更加牢固,材料與體液或者模擬體液產生離子交換以及結構中的離子擴散越困難,在生理環境中形成碳酸羥基磷灰石層的能力也下降。而溶膠- 凝膠生物玻璃組成中的SiO2 含量可達80 mol%,仍可保持一定的生物活性[64]。2007年,Jones 課題組又研制出CaO-SiO2 二元系統溶膠- 凝膠生物活性玻璃,組成中的SiO2 含量達到90 mol%,仍可保持一定的生物活性[65]。此外,由于溶膠- 凝膠工藝對材料的可設計性,不同元素如Na、Mg、Zn、Sr 等通過溶膠- 凝膠都可添加到生物活性玻璃材料中[66-69]。
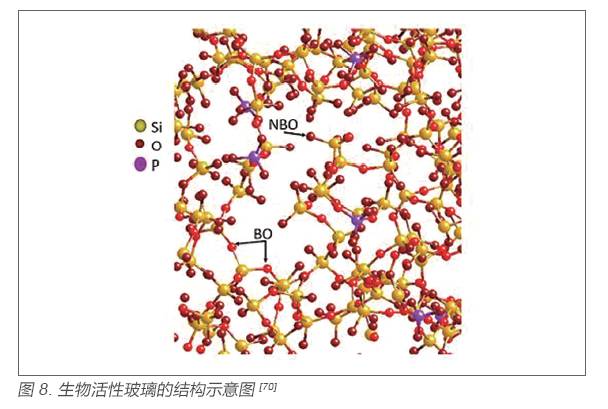
除了材料的組成與材料的生物活性有關,材料的結構也影響著材料的性能。生物活性玻璃的離子釋放性能及其體外磷灰石形成能力與其結構密切相關。雖然不同方法制備的生物活性玻璃可能具有不同的組成,不同的比表面積等性能,但所有生物活性玻璃均具有類似的網絡結構。首先,生物玻璃的網絡結構主要是由硅氧四面體構成,硅氧四面體中三個氧原子與相鄰四面體共用,而磷氧四面體通過Si-O-P 鍵同硅氧四面體相連;其次,玻璃網絡中的Ca2+、Na+ 或其他堿金屬離子以網絡外體的形式存在,并使得玻璃網絡結構部分破壞,形成非橋氧鍵(Onb),非橋氧鍵數量的增多,使得網絡結構更加疏松,玻璃溶解性增加,從而加快了生物活性玻璃的離子釋放速度,同時也增強了生物活性玻璃的生物活性[3,70]。生物活性玻璃的結構示意圖如圖8 所示。
1.3 生物活性玻璃的降解與磷灰石形成活性
與生物惰性材料相比,生物活性玻璃優勢體現在其可降解性和生物活性。生物活性玻璃作為一類典型的硅酸鹽材料,在體液環境中會被溶解,同時伴隨著玻璃網絡結構中的離子釋放,導致玻璃網絡骨架的破壞,從而生物活性玻璃發生降解,因此生物活性玻璃是一種生物可降解材料。同時,生物玻璃的降解過程與其體外誘導磷灰石形成過程密切相關。在體液環境下,材料中首先有大量的玻璃網絡中的鈣、鈉等離子釋放,與溶液中氫離子快速進行交換,表面形成大量的硅羥基基團,玻璃結構的Si-O-Si 鍵斷裂,可溶性硅溶出,材料與溶液界面形成更多的硅羥基,在這種弱堿環境下,硅羥基聚合形成帶負電的富硅凝膠層,從而吸附鈣離子和磷酸根離子沉積在硅凝膠層表面,形成無定形結構的磷酸鈣層;磷酸鈣晶化成后變為羥基磷灰石(HA),晶化過程中有碳酸根等進入晶格則形成碳酸羥基磷灰石(HCA)。在整個過程中,材料的離子釋放與磷灰石的沉積是同時進行的,隨著生物活性玻璃的降解,磷灰石也相繼形成。磷灰石層形成后可吸附周圍環境中蛋白分子,利于細胞黏附、增殖及分化后最終形成骨基質,參與到生命過程中[2,29]。長久以來,生物活性玻璃在體液或者模擬體液中誘導HA 沉積的能力是評判生物活性玻璃材料生物活性高低的重要依據[64,71]。影響磷灰石層形成能力的因素有很多,其中包括材料組成、材料形態、孔結構、顆粒尺寸及比表面積等[56,72,73]。
1.4 生物活性玻璃的基因激活性能
隨著對生物活性玻璃材料研究的不斷深入,“生物活性”的概念已經不能局限于材料是否具有誘導磷灰石形成的能力,材料是否具有細胞相容性、是否能刺激細胞發生積極的應答反應等性質也成為生物活性玻璃材料生物活性的重要評價依據。近年來的研究發現,生物活性玻璃具有良好的細胞相容性,促進細胞增殖,并誘導成骨細胞分化,促進骨修復,且關鍵在于生物活性玻璃具有誘導細胞向成骨分化的基因激活作用[2,74]。研究表明,生物玻璃在與水介質接觸后,可溶性Si、Ca 等離子基團釋放所形成的局部微環境,有利于刺激成骨細胞或骨祖細胞的增殖與分化,且當細胞與生物玻璃的溶解物質接觸時,在數小時內便有七種與成骨細胞分化密切相關的基因被激活,說明生物玻璃具有基因激活性能[75,76]。還有研究發現生物玻璃釋放的硅、鈣等離子可能刺激某條或多條成骨相關的信號通路,從而激活成骨相關基因的表達和蛋白合成,促進細胞礦化成骨[77,78]。
1.5 微納米顆粒與細胞間的相互作用
隨著微納米生物玻璃研究的興起,因此全面了解材料與細胞間的相互作用是微納米生物活性玻璃的研究重點。當細胞與顆粒材料接觸后,細胞膜會因為外界刺激而發生響應,進而通過信號因子的傳遞導致整個細胞行為的變化[79,80]。
1.5.1 顆粒形態的影響
隨著微納米顆粒形貌調控技術的發展,微納米顆粒的形狀以及空間排布對細胞作用的影響越來越受到關注。細胞膜對不同形狀微納米顆粒的響應存在著差異,在顆粒與細胞接觸作用中,細胞膜功能和膜上分子的運動都會不同程度地受到所吸附的顆粒形狀變化的調控,進而可能影響細胞對顆粒的內吞作用,細胞內吞的發生會誘導細胞生長和分化等行為的變化[80,81]。Huang 等[82]研究發現介孔硅材料會被細胞內吞且與細胞間的相互作用存在著形貌效應,相比球形顆粒,細胞對棒狀顆粒有著更多的內吞量和更快的內吞速率,對細胞的黏附、遷移和增殖等影響更大;Xu 等[83]發現針狀和短棒的HA 納米顆粒比球形HA 顆粒更容易造成對細胞正常行為的抑制;而對生物活性玻璃而言,除去細胞內吞作用影響,生物活性玻璃中釋放的Si 和Ca 等離子的濃度直接影響到細胞適應性,濃度過低或過高均不利于細胞正常行為[2] ;而顆粒的形貌、分散性顯然影響著其比表面積進而影響著活性離子的釋放,本課題組雷波[56] 研究發現,相比于不規則形態的生物活性玻璃顆粒相比,具有規則球形形貌的生物活性玻璃材料因為具有更好的離子釋放性能,因為顯示出更好的細胞相容性,更促進細胞增殖和分化。然而,對于具有不同形態如棒狀、球形等的生物活性微納米顆粒對細胞行為影響比較的研究還鮮有報道。
1.5.2 顆粒尺寸的影響
尺寸效應是微納米顆粒研究中最受關注的一個方面,顆粒尺寸能夠顯著影響細胞對材料的吞噬作用[84,85]。當顆粒尺寸足夠小時通過擴散作用自由通過細胞膜而進入細胞內部,對大顆粒而言,細胞通過特異性攝取對材料進行內吞。Vallhov等[86] 研究發現小尺寸和低濃度的介孔二氧化硅材料會對細胞的活力、細胞內吞有著更小的影響;Huang 等[87] 認為,HA 納米顆粒相比微米顆粒,不僅促進骨髓間充質干細胞增殖,還能上調成骨相關基因的表達;Tobias 等[88] 發現大尺寸(~32 μm)顆粒明顯誘發細胞產生炎癥現象,而小尺寸顆粒(~1 μm)幾乎不會誘發細胞出現炎癥;同樣對于生物活性玻璃而言,生物活性玻璃顆粒尺寸還影響著其比表面積而降解性能,小尺寸生物玻璃可能具有更大的比表面積,高的比表面積提供更多的表面吸附位點,因而增加了表面蛋白和生長因子的吸附,進一步促進了細胞的增殖。本課題組雷波[48] 比較了不同尺寸(40~180 nm、400~800 nm、2000~4000 nm)的生物活性玻璃顆粒對細胞學性能的影響,發現40~180 nm 組具有更高的比表面積,呈現更好的細胞黏附和增殖性能。
綜上所述,微納米顆粒的形貌、分散性和尺寸大小都會影響其與細胞之間的相互作用,而不同材料的顆粒對不同細胞可能會發生不同的細胞響應行為。因為材料的結構組成、表面電荷、理化性能、細胞膜組分存在差異性, 因此需要根據不同生物需求,選擇合適的材料與細胞進行研究。
1.6 微量元素摻雜對生物活性玻璃性能的影響
前面論述到生物活性玻璃的Si、Ca、P 等離子溶出產物能夠刺激成骨細胞或骨祖細胞的增殖與分化,且成骨細胞分化密切相關的基因被激活。然而除了Si、Ca、P 等傳統生物活性玻璃的主要組成元素外,一些微量元素同樣有著積極的生物學效應,而且溶膠- 凝膠工藝對材料的具有可設計性,因此根據應用需求,一些微量元素如Mg、Zn、Sr 等可通過溶膠- 凝膠引入到生物活性玻璃材料中,從而進一步提高生物活性玻璃的性能。
鎂(Mg)元素是骨代謝過程的重要元素,影響成骨和破骨細胞的活性,促進骨細胞的增殖和穩定性,刺激新骨形成[89,90]。有研究報道,Mg摻雜的生物玻璃(Mg-BG)由于Mg 的引入破壞了玻璃的網絡結構,因而具有更快離子釋放速率[91]。然而,Varanasi 等[92] 發現Mg-BG 的浸提液與細胞共培養,與成骨分化相關的基因如COL-I、ALP、Runx 2 表達量上調。
鋅(Zn)元素是重要的微量元素,它參與DNA 及蛋白的合成,并通過蛋白合成刺激骨形成,且能夠增加ATP 酶活性,調節成骨分化相關基因如COL-I、ALP、OCN 的表達[93,94]。有報道發現ZnO 取代CaO 而引入到摻生物玻璃(Zn-BG),由于Zn-O 鍵能達到180 KJ/mol,大于Ca-O 的鍵能110 kJ/mol,因而Zn 離子很難從玻璃中溶出,進一步減緩了Si、Ca 等離子的釋放,也抑制了其磷灰石形成能力[95]。
鍶(Sr)元素同樣是一種人體內重要的微量元素,且與骨組織間有良好的親和性[96]。低劑量的Sr 能夠有效地治療骨質疏松癥,目前藥物雷尼酸鍶在治療骨質疏松癥上起到良好的效果[97,98]。研究發現,一定量的Sr 能夠促進成骨細胞增殖、分化,同時通過抑制破骨細胞形成防止骨組織再吸收,從而促進新骨的長成[99,100]。
顯然,摻入一定量的微量元素可能進一步提高生物活性玻璃的理化性能以及生物學性能,因此在制備過程中摻入某種或幾種元素至生物活性玻璃網絡結構中,更好的應用于組織缺損修復也是生物活性玻璃研究的一個可行重要方向。
1.7 生物活性玻璃在齒科修復中的研究
生物活性玻璃由于其特有的無機非晶態結構、促進生物礦化以及基因激活等優異性能、被認為是一類優越的骨、齒科修復材料,生物活性玻璃在骨、齒科修復體已經有了廣泛的臨床應用。熔融法制備的生物玻璃骨、齒科修復體現已在許多發達國家應用于臨床治療,收到良好的治療效果。如植入由牙周病或慢性根尖周炎造成的頜骨缺損區,能夠促進新骨形成、提高人工種植牙與頜骨的結合強度等。將生物玻璃植入拔牙后形成的牙槽窩,可以防止由于牙槽嵴萎縮給后續的義齒修復帶來的困難[101]。
牙本質和骨均為天然的礦化組織,雖然二者物理屬性不同,但它們之間有類似的組成成分、形成機制和生物學特點,生物活性玻璃在骨缺損修復中的成功應用也預示著其有可能應用于牙髓組織損傷的修復再生。目前關于生物活性玻璃在牙髓損傷修復方面的研究還相對較少。上世紀90年代,研究者嘗試將生物活性玻璃作為蓋髓材料。動物實驗表明,用45S5 生物玻璃蓋髓可明確形成牙本質橋,牙本質橋下方的牙髓炎癥輕于用氫氧化鈣蓋髓。生物活性玻璃蓋髓劑能提供良好的生物礦化微環境,誘導牙髓細胞分化,促進修復性牙本質形成[102]。北大米姍姍等人[103] 將溶膠-凝膠生物活性玻璃浸提液與人牙髓細胞進行體外培養,發現生物玻璃浸提液能促進牙髓細胞增殖以及ALP 活性的提高,提示生物活性玻璃與牙髓細胞具有良好的生物相容性,且對牙髓細胞分化有積極作用。近期有學者報道[104] 將人牙髓細胞接種于45S5 生物活性玻璃支架材料進行體外培養,發現細胞成骨相關基因如Runx 2,OCN 等表達量提高,二者共同植入裸鼠體內能生成骨樣礦化物質,提示45S5 生物玻璃能夠增強人牙髓細胞的礦化能力。本課題組與北大口腔醫學院合作將生物活性玻璃與牙髓組織復合后裸鼠皮下埋植發現生物活性玻璃對牙髓具有良好的成牙誘導能力,能夠促進牙髓牙本質復合體的生成[105]。
雖然目前關于生物活性玻璃在牙髓損傷修復方面的研究還相對較少,但從已有的研究報道可以提示生物活性玻璃在牙髓牙本質再生方面具有良好的應用前景。
公司匯集新材料研究領域具有多年開發經驗的專家技術人員,以獨有的技術開發了納米銀水溶膠、納米銀油性溶膠、納米銀凝膠、抗菌母粒、納米銀復合粉體、納米金溶膠、納米金凝膠、無色絡合納米銀溶液、銀離子白色抗菌粉體、銀鋅抗菌防霉劑、銀鋅銅復合抗菌防霉抗藻劑、銀離子粉體、生物活性玻璃粉體、生物活性玻璃-Ag復合粉體、生物用磷灰石-Ag復合粉體等等一系列新型先進功能材料,在消毒殺菌、抗菌抗藻防霉、醫療衛生、生物醫藥、日化、保健、紡織、生物工程、農林牧業、寵物家居、節能減排等等與人們生活密切相關的領域具有極其廣闊的應用前景。目前客戶利用本公司原料成功開發了納米銀婦用凝膠、納米銀漱口水、納米銀空氣清新劑、納米銀抗菌刮痧器、納米銀衛生筷、納米銀抗菌耳機、納米銀粉末涂料、納米銀衛生巾芯片、納米銀保鮮膜、納米銀抗菌奶瓶、納米銀抗菌無紡布、生物活性玻璃牙膏、寵物用抗菌消毒噴劑、日常家居用抗菌消毒噴劑、汽車消毒除味劑、抗菌吸汗除味粉劑、抗菌硅膠片、抗菌防霉玻璃膠、抗菌防藻網箱/漁網等等一系列性能優異的實用新型產品,為保證老百姓的身心健康發揮了巨大作用,也給客戶帶來了實實在在的利益與信心。
聯系我們:
廣州市科瑨材料科技有限公司 (sharewhatyouteach.com)
業務咨詢:13602870664 / 020-84178402 ,E-mail:13602870664@139.com
聯系地址:廣東省廣州市海珠區新港東路70號
 微信
微信



